
Tóm tắt
Gần đây, Công ty TNHH sản phẩm sinh học của Nanjing Liming (www.limingbio.com) SARS-CoV-2 LGM/IgG Antibody Rapid Kit đã được chứng nhận chứng nhận ANVISA. Đồng thời, SARS-CoV-2 RT-PCR và bộ thử nghiệm nhanh IgM/IgG cũng được liệt kê trong danh sách mua sắm được đề xuất chính thức của Indonesia. Trong khi đó, Liming Bio Strongstep®Novel Coronavirus (SARS-CoV-2) Bộ PCR thời gian thực theo thời gian thực, đã được Cơ quan Khoa học Sức khỏe Singapore (HSA) phê duyệt và nhận được chứng chỉ HSA.

Hình 1 Chứng nhận Anvisa Brazil
Chứng nhận Brazil (Anvisa)
Anvisa, được gọi là Agência Nacional de Vigilância Sanitária, là cơ quan quản lý thiết bị y tế Brazil. Một công ty cần phải đăng ký với ANVISA, Cơ quan giám sát y tế quốc gia, để bán các thiết bị y tế một cách hợp pháp tại Brazil. Để được chứng nhận, những thiết bị y tế vào Brazil phải đáp ứng các yêu cầu của GMP Brazil cùng với các tiêu chuẩn cụ thể do chính quyền Brazil đặt ra. Ở Brazil, các thiết bị y tế IVD được phân loại thành lớp I, II, III và IV theo mức độ rủi ro từ thấp đến cao. Đối với các sản phẩm loại I và II, phương pháp học chính được áp dụng, trong khi đối với các sản phẩm loại III và IV, phương pháp đăng ký được sử dụng. Sau khi đăng ký thành công, số đăng ký sẽ được AVISA cấp và dữ liệu sẽ được tải lên cơ sở dữ liệu thiết bị y tế Brazil, số này và thông tin đăng ký tương ứng của nó sẽ xuất hiện trên Dou (Diário oficial da União).


Hình ảnh 2 Chứng chỉ Cơ quan Khoa học Sức khỏe Singapore (HSA)


Hình 3 Danh sách mua sắm được đề xuất chính thức của Indonesia

Hình 4 Strongstep®Thử nghiệm nhanh chóng kháng thể SARS-CoV-2 IgM/IgG
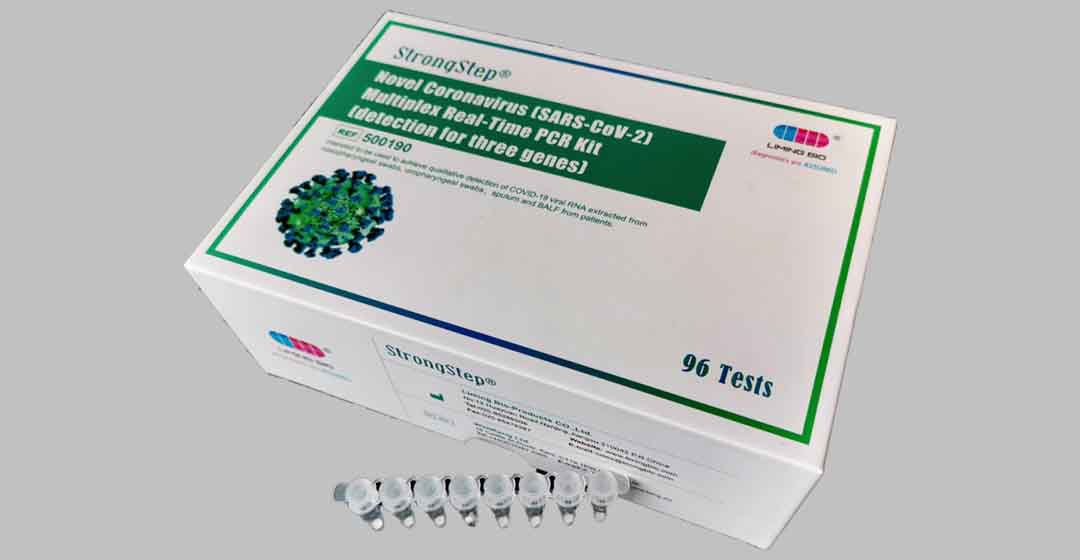
Hình ảnh 5 Novel Coronavirus (SARS-CoV-2) Bộ PCR thời gian thực đa
Ghi chú:
Bộ PCR rất nhạy cảm, sẵn sàng sử dụng này có sẵn ở định dạng đông khô (quá trình làm khô) để lưu trữ dài hạn. Bộ này có thể được vận chuyển và lưu trữ ở nhiệt độ phòng và ổn định trong một năm. Mỗi ống của Promix chứa tất cả các thuốc thử cần thiết cho khuếch đại PCR, bao gồm transcriptase ngược, Taq polymerase, mồi, đầu dò và chất nền DNTP. Nó chỉ cần thêm 13ul nước cất và mẫu RNA chiết 5ul, sau đó nó có thể được chạy và khuếch đại trên các dụng cụ PCR.
Khó khăn trong việc vận chuyển chuỗi lạnh của thuốc thử phát hiện axit nucleic coronavirus mới
Khi các thuốc thử phát hiện axit nucleic thông thường được vận chuyển trong khoảng cách xa, cần phải lưu trữ và vận chuyển chuỗi lạnh (-20 ± 5) để đảm bảo hoạt tính sinh học của enzyme trong thuốc thử vẫn hoạt động. Để đảm bảo rằng nhiệt độ đạt đến tiêu chuẩn, một vài kg băng khô là cần thiết cho mỗi hộp thuốc thử thử nghiệm axit nucleic thậm chí dưới 50g, nhưng nó chỉ có thể kéo dài trong hai hoặc ba ngày. Theo quan điểm của thực tiễn công nghiệp, trọng lượng thực tế của thuốc thử do các nhà sản xuất ban hành là ít hơn 10% (hoặc ít hơn nhiều so với giá trị này) của container. Hầu hết trọng lượng đến từ băng khô, túi nước đá và hộp bọt, vì vậy chi phí vận chuyển là cực kỳ cao.
Vào tháng 3 năm 2020, Covid-19 bắt đầu bùng phát ở quy mô lớn ở nước ngoài và nhu cầu về thuốc thử phát hiện axit nucleic coronavirus mới tăng lên đáng kể. Mặc dù chi phí cao xuất khẩu thuốc thử trong chuỗi lạnh, hầu hết các nhà sản xuất vẫn có thể chấp nhận nó do số lượng lớn và lợi nhuận cao.
Tuy nhiên, với việc cải thiện các chính sách xuất khẩu quốc gia đối với các sản phẩm chống đỗ xe, cũng như nâng cấp kiểm soát quốc gia đối với dòng người và hậu cần, có sự mở rộng và sự không chắc chắn trong thời gian vận chuyển của thuốc thử bằng phương tiện giao thông. Thời gian vận chuyển kéo dài (thời gian vận chuyển khoảng nửa tháng là rất phổ biến) dẫn đến sự cố sản phẩm thường xuyên khi sản phẩm đến khách hàng. Điều này đã gây rắc rối cho hầu hết các doanh nghiệp xuất khẩu thuốc thử axit nucleic.
Công nghệ đông khô cho thuốc thử PCR đã giúp vận chuyển thuốc thử phát hiện axit nucleic coronavirus mới trên toàn thế giới
Các thuốc thử PCR đông khô có thể được vận chuyển và lưu trữ ở nhiệt độ phòng, điều này không chỉ có thể làm giảm chi phí vận chuyển, mà còn tránh các vấn đề chất lượng do quá trình vận chuyển gây ra. Do đó, đông khô thuốc thử là cách tốt nhất để giải quyết vấn đề xuất khẩu vận chuyển.
Lyophilization liên quan đến việc đóng băng dung dịch vào trạng thái rắn, sau đó thăng hoa và tách hơi nước trong điều kiện chân không. Các chất tan khô vẫn còn trong thùng chứa có cùng thành phần và hoạt động. So với các thuốc thử chất lỏng thông thường, thuốc thử phát hiện axit nucleic nucleic tiểu thuyết đầy đủ thành phần được tạo ra bởi Liming Bio có các đặc điểm sau:
Tính ổn định nhiệt cực mạnh: Nó có thể xử lý đứng ở mức 56 trong 60 ngày, và hình thái và hiệu suất của thuốc thử vẫn không thay đổi.
Lưu trữ và vận chuyển nhiệt độ bình thường: Không cần chuỗi lạnh, không cần lưu trữ ở nhiệt độ thấp trước khi không được tiết lộ, giải phóng hoàn toàn không gian lưu trữ lạnh.
Sẵn sàng sử dụng: Phân ly của tất cả các thành phần, không cần cấu hình hệ thống, tránh mất các thành phần có độ nhớt cao như enzyme.
Các mục tiêu đa kênh trong một ống: Mục tiêu phát hiện bao gồm gen coronavirus orf1ab mới, gen N, S để tránh genovariation virus. Để giảm âm tính giả, gen RNase P của con người được sử dụng làm kiểm soát nội bộ, để đáp ứng nhu cầu lâm sàng để kiểm soát chất lượng mẫu.
SARS-COV-2 IgM/IgG Thử nghiệm nhanh chóng và bộ PCR mới coronavirus (SARS-CoV-2) (phát hiện cho ba gen) trước đây của FDA ở Mỹ.
Công ty TNHH sản phẩm sinh học của Nanjing Liming luôn đặt chất lượng của bộ dụng cụ thử nghiệm vào nơi đầu tiên, và tập trung vào việc mở rộng công suất. Công ty sẽ cung cấp các sản phẩm và dịch vụ thử nghiệm Covid-19 chất lượng cao cho các tổ chức y tế trên toàn thế giới và đóng góp cho việc phòng ngừa và kiểm soát dịch bệnh toàn cầu, để xây dựng một cộng đồng toàn cầu về tương lai chung.
Nhấn dài ~ Quét và theo dõi chúng tôi
E-mail:sales@limingbio.com
Trang web: https://limingbio.com

Thời gian đăng: Tháng 7-06-2020







